Les ions sont des solutés chargés particulièrement importants en physiologie car :
• ils représentent plus de 90 % de l’osmolarité des liquides biologiques ;
• leur charge empêche leur diffusion simple à travers la bicouche lipidique ;
• leur charge leur confère la propriété de générer des signaux électriques ;
• ils peuvent réguler le fonctionnement de nombreuses protéines (Ca2+et Mg2+).
Principe général régissant la diffusion des ions
Les ions, du fait de leur charge, subissent, en plus du gradient chimique, des phénomènes d’attraction et de répulsion électrostatiques, les charges identiques se repoussant alors que les charges opposées s’attirent. La membrane plasmique est une bicouche phospholipidique isolante qui permet d’accumuler sur chacune de ses faces des charges électriques opposées, et donc de maintenir un gradient électrique de part et d’autre de la membrane.
Origine du gradient chimique
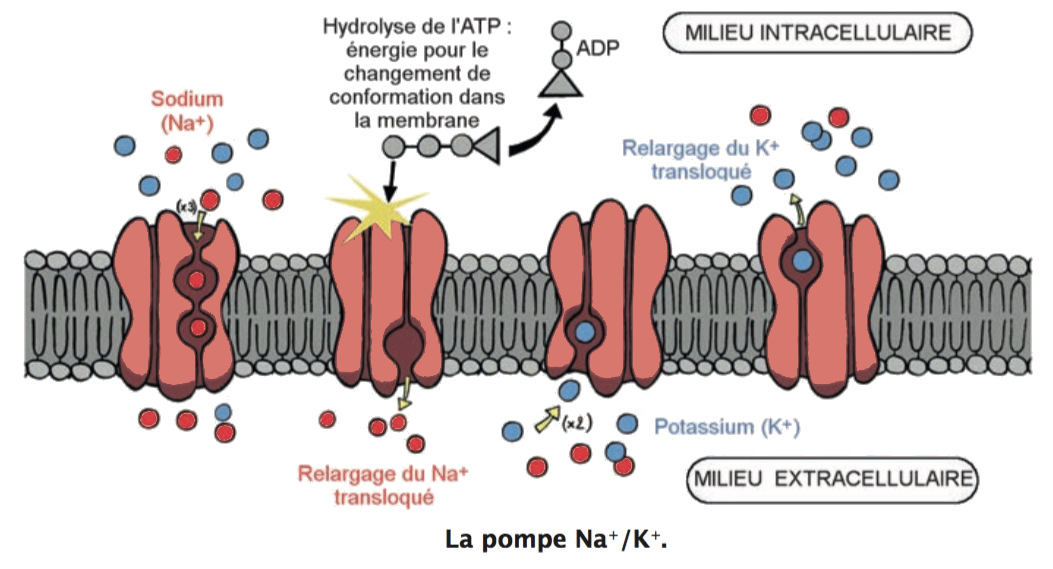
La pompe Na+/K+ de la membrane plasmique assure un transport actif primaire qui extrude trois ions Na+ et fait entrer deux ions K+ dans les cellules contre leurs gradients respectifs en hydrolysant une molécule d’ATP. Cette pompe, exprimée de manière ubiquitaire, est responsable des gradients chimiques de Na+ et K+ transmembranaires.
Gradient électrique transmembranaire
Quand la membrane est perméable aux ions (canaux ouverts), leur diffusion génère un ux de charges qui engendre une différence de potentiel (ddp). Si on mesure la ddp entre l’intérieur de la cellule et l’extérieur à l’aide d’électrodes reliées à un voltmètre, on constate que cette ddp est négative. La ddp membranaire est appelé potentiel de membrane (Vm) et constitue un gradient électrique qui attire ou repousse les ions.
Potentiel électrochimique
Le potentiel électrochimique représente la faculté à modifier la quantité d’une espèce chimique X en solution en un point de l’espace. Exprimée en J·mol−1, sa valeur est déterminée par :
μ(X) = R × T × Ln(C(X)) + z × F × E
avec R = constante des gaz parfaits (8,32 J·mol−1·K−1), T = température (en K), C = concentration (en mol·L−1), E = potentiel (en V), F = 96 500 Cb, z = valence.
Gradient électrochimique et équilibre électrochimique
L’existence d’une charge électrique sur une face de la membrane attire ou repousse les charges ioniques se trouvant en vis-à-vis.
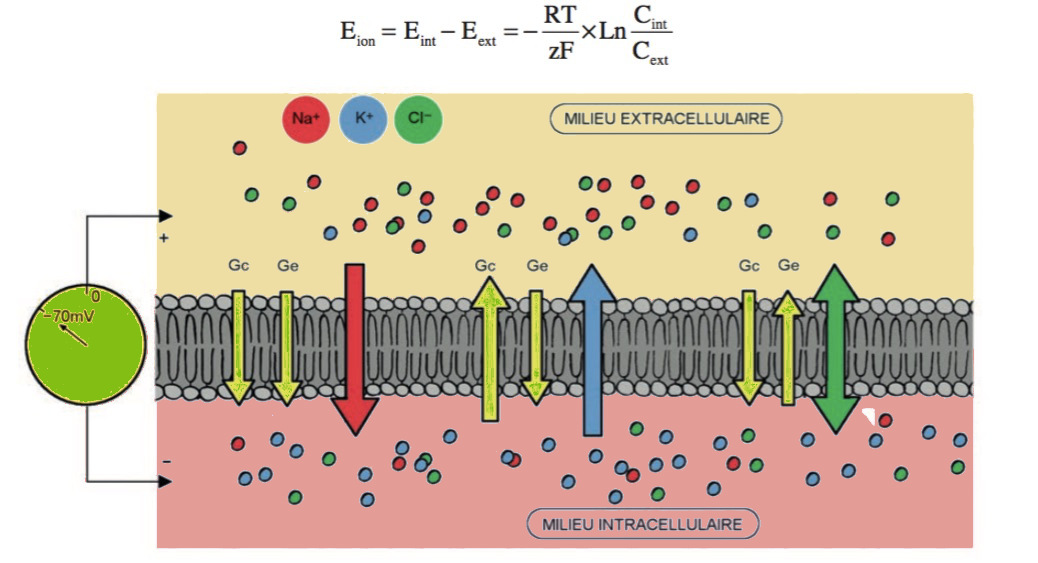
le Na+ est attiré vers le cytoplasme par le gradient électrique (car la face interne de la membrane est chargée négativement et attire donc les cations) et par le gradient chimique. Le K+ est attiré vers le cytoplasme par le gradient électrique, et vers le milieu extracellulaire par le gradient chimique. Si la membrane est perméable à ces ions (si les canaux sont ouverts), ils vont diffuser dans le sens du gradient électrochimique, somme des gradients chimiques et électriques. Il est nécessaire de pouvoir calculer le gradient de manière à déterminer le sens de diffusion des ions.
Chaque ion est soumis à deux forces, électrique et chimique. Lorsque celles-ci sont égales et de sens opposé, l’ion est dit à l’équilibre. Cette situation survient pour une certaine valeur du potentiel de membrane (différence de potentiel entre l’intérieur et l’extérieur de la cellule), appelée potentiel d’équilibre pour l’ion X (Eion). Cette valeur est calculée par l’équation de Nernst :

Les gradients chimiques (Gc) et électriques (Ge)
déterminent la diffusion des ions à travers la membrane.
Les gradients électrochimiques peuvent être déterminés en calculant la différence de potentiel électro- chimique Δμ pour chaque ion. Pour Na+ (en rouge), Δμ(X) < 0, l’ion diffuse de l’extérieur vers l’intérieur de la cellule ; pour K+ (en bleu), Δμ(X) > 0, l’ion diffuse de l’intérieur vers l’extérieur ; pour Cl− (en vert), Δμ(X) = 0, l’ion est à l’équilibre électrochimique.

Gradient électrochimique d’un ion en solution Δμ
C’est la différence entre les potentiels électrochimiques d’un ion dans deux compartiments A et B :
Δμ = μA – μB = R × T × Ln(CA(X)/CB(X)) + z × F × (EA – EB)