Les mouvements de l’eau, solvant biologique, entre les différents secteurs liquidiens peuvent provoquer des variations de concentration des solutés très importantes.
L’eau diffuse par osmose
Cette diffusion s’effectue du compartiment le plus riche en eau vers le milieu le moins riche. La présence de solutés dans une solution diminuant la concentration en molécules d’eau, l’osmose s’effectue des secteurs les moins concentrés vers les plus concentrés en solutés. Ce flux d’eau aboutit à équilibrer les concentrations de part et d’autre de la membrane. Bien que l’eau puisse traverser les bicouches lipidiques par diffusion simple malgré son caractère hydrophile, la perméabilité à l’eau des membranes plasmiques est considérablement augmentée par des canaux spécifiques, les aquaporines.

Notion d’osmolarité et de pression osmotique
La concentration totale s’appelle l’osmolarité, et est exprimée en Osmol·L−1 et correspond à la somme des concentrations en solutés (exprimées en mol·L−1) en tenant compte de la dissociation des ions en solution.
L’osmolarité efficace sur les mouvements d’eau s’appelle la tonicité (C, exprimée en Osmol·L−1). La présence de solutés perméants, qui diffusent simplement et s’équilibrent de part et d’autre de la membrane, n’in uence pas les mouvements d’eau, La tonicité ne tient donc compte que de la concentration des solutés imperméants. L’osmolarité d’une solution contenant 150 mM de NaCl est ainsi de 300 mOsm·L−1, correspondant à la somme des concentrations de Na+ et Cl−.
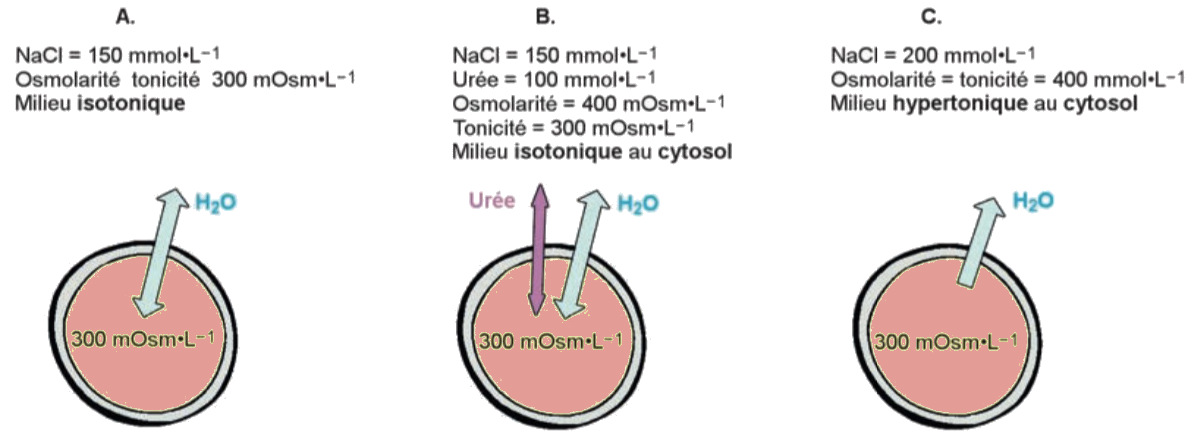
Osmolarité et tonicité.
- A. Les tonicités physiologiques du cytosol et du plasma sont identiques ; les flux d’eau sont à l’équilibre.
- B. Le milieu contient une molécule perméante (par exemple l’urée), qui diffuse et s’équilibre de part et d’autre de la membrane. Sa présence n’influence donc ni la tonicité ni l’osmose.
- C. La concentration en espèces imperméantes (NaCl) est modifiée, la tonicité est affectée. Les concentrations en NaCl et en urée
sont les concentrations extracellulaires.

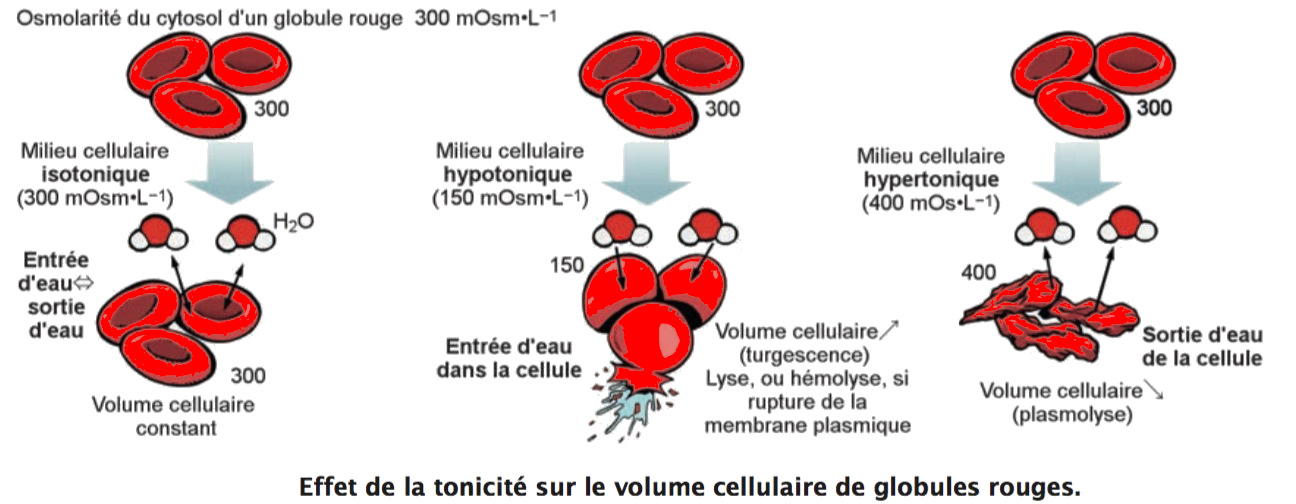
Deux solutions d’osmolarité identique sont dites iso-osmotiques. Une solution de faible osmo- larité est dite hypo-osmotique au regard d’une autre plus concentrée (hyperosmotique). Deux solutions de tonicité identique sont dites isotoniques. Une solution de plus faible tonicité qu’une autre est dite hypotonique au regard de la première (hypertonique).
Les mouvements d’eau peuvent entraîner des variations de volume des compartiments liquidiens. L’eau étant la molécule la plus abondante de l’organisme, tout mouvement de sa part entraîne des variations de volume des secteurs concernés. Des cellules plongées dans une solution hypotonique subissent une entrée d’eau et une augmentation de leur volume cellulaire pouvant aboutir à la rupture de leur membrane plasmique, ou lyse cellulaire. A contrario, des cellules plongées dans une solution hypertonique subissent une diminution de volume cellulaire ou plas-molyse, due à une fuite d’eau
Pression oncotique et pression hydrostatique
Au sein des différents liquides organiques, la concentration totale en solutés est relativement identique et influence peu les mouvements d’eau. En revanche, la concentration en protéines libres est très différente entre les compartiments, forte dans les cellules et le plasma et faible dans le liquide interstitiel. La pression osmotique spécifique aux protéines est nommée pression oncotique et influence les mouvements et la circulation de liquides entre les différents compartiments. La circulation d’eau entre le plasma et le liquide interstitiel est dépendante de deux forces : la pression oncotique qui attire l’eau vers le plasma et la pression hydrostatique (due à la pression sanguine) qui pousse l’eau du sang vers le liquide interstitiel. La différence de ces deux forces entraîne des ux de liquides du sang vers les tissus (côté artériole du lit capillaire) ou des tissus vers le sang (côté veinule).
Pression osmotique (π) d’une solution : C’est une force qui attire l’eau depuis une autre solution à travers une membrane semi-perméable séparant les deux compartiments. L’osmose s’effectue des zones de faible π vers les zones de forte π. La valeur de π est donnée par la loi des gaz parfaits et s’exprime en pascal : π = R × T × C R = constante des gaz parfaits (8,32 J⋅mol–1⋅K–1), T = température (en K).